(4)
表を見てみると、
試験管FのBTB溶液が緑色で、
中和完了していることがわかる。
問題で問われている試験管Gは、
BTB溶液が青色だからアルカリ性。
水酸化ナトリウム(NaOH)水溶液は
アルカリ性を示すので、
このパターンは、
中和完了してたのに、
さらにNaOH入れちゃいました(テヘっ)
というパターン。
(テヘっ)じゃねーよと思いながら、
イオンの数を確認!
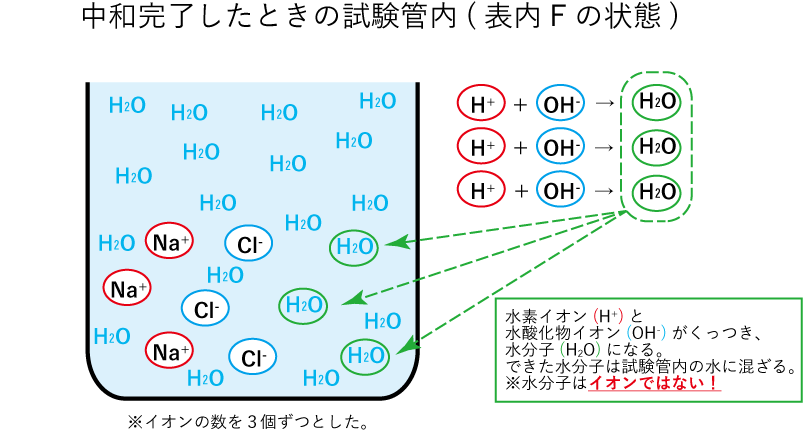
下の図は、
中和完了したときの、
試験内のイオン数を
図にしたものです。
さらにNaOHを入れて
試験管Gの状態になっている。
Na+とOH–が仮に1つずつ入ったとすると、
試験管G内のイオンの数は
●Na+:4つ
●Cl–:3つ
●OH–:1つ
となるはず。
よって、
最も多く存在するイオンは
Na+ということがわかる、と。
ちなみに試験管Gが
アルカリ性を示すのは、
このOH–1つのせいですな。
水酸化イオンOH–は、
「アルカリ」と呼ばれ、
アルカリ性を示す元となるイオンでしたねん。
(5)
試験管B〜Eは
塩酸に水酸化ナトリウム水溶液を
入れ続けている状態で、
中和が進んでいるところ。
これがわかれば、
問題文Zの内容は
中和が起こっている
だとすぐわかる!
今回は、
塩酸に水酸化ナトリウム水溶液を
入れていく中和の実験。
(水酸化ナトリウム水溶液に塩酸を
入れていくパターンではない)
試験管Aでは、
塩酸が電離して
H+とCl–が試験管中にある。
このうち水素イオンH+は「酸」と呼ばれ、
これが水溶液中にあると、
水溶液は酸性を示すので、
試験管Aの水溶液は酸性。
そこに
水酸化ナトリウム水溶液NaOHを加えていくと、
電離してNa+とOH–となり、
このOH–が
試験管内に元からあったH+と反応し、
水(H2O)になる。
H2Oはイオンではない。
つまり、
水酸化ナトリウム水溶液を入れれば入れるほど、
OH–が多く入り、H+と反応するので、
H+の数が減っていく。
H+の数が減っていくので、
酸性が弱まっていき、
中性に(中和完了に)近づいていく。
ちょっと長いけど、
中和の仕組みの基本だなぁ。
・・・ということで、答えとしては
●X:水素イオン
●Y:弱く
となりますね!
問題としては決して難しくない!
基本をきちんと問われた感じでした。
ということで、
大問2の解説終了します!
大問3へ続く!
To Be Continued…

